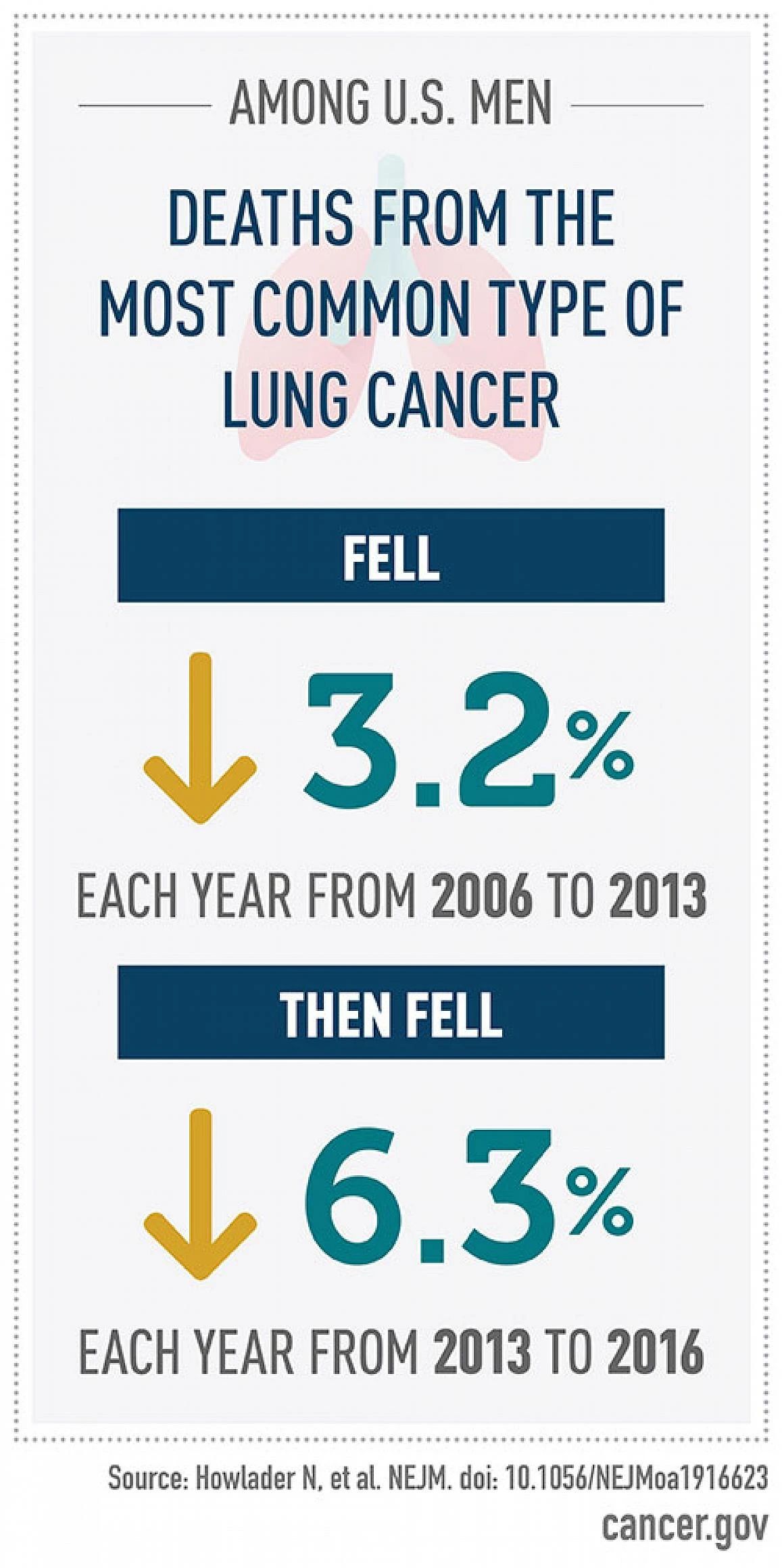
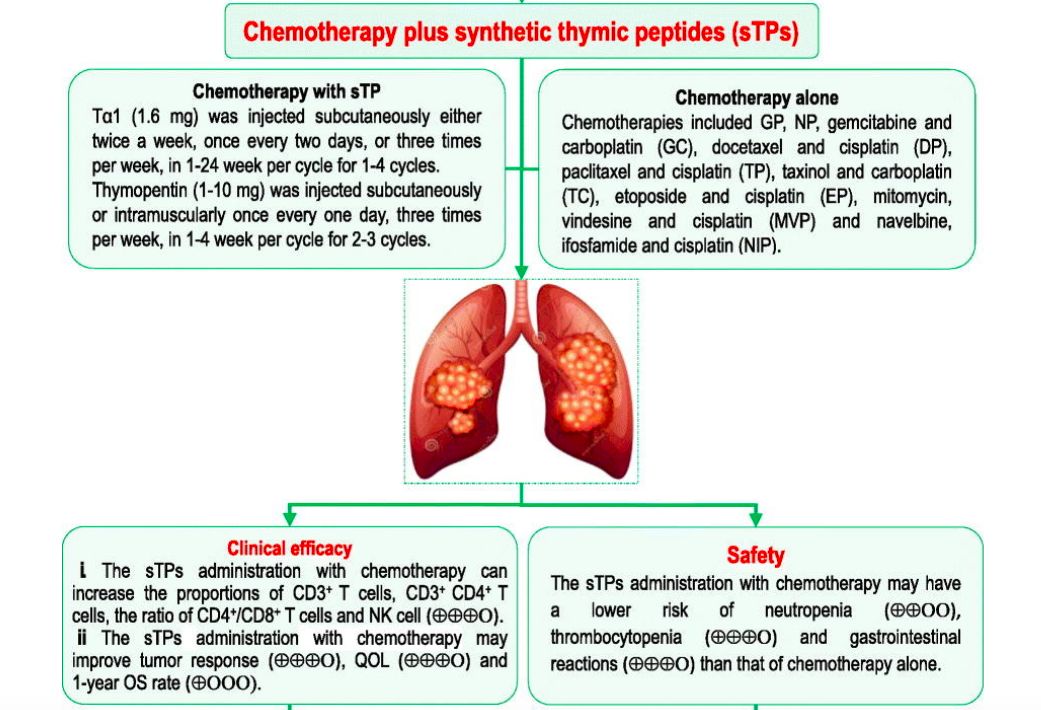
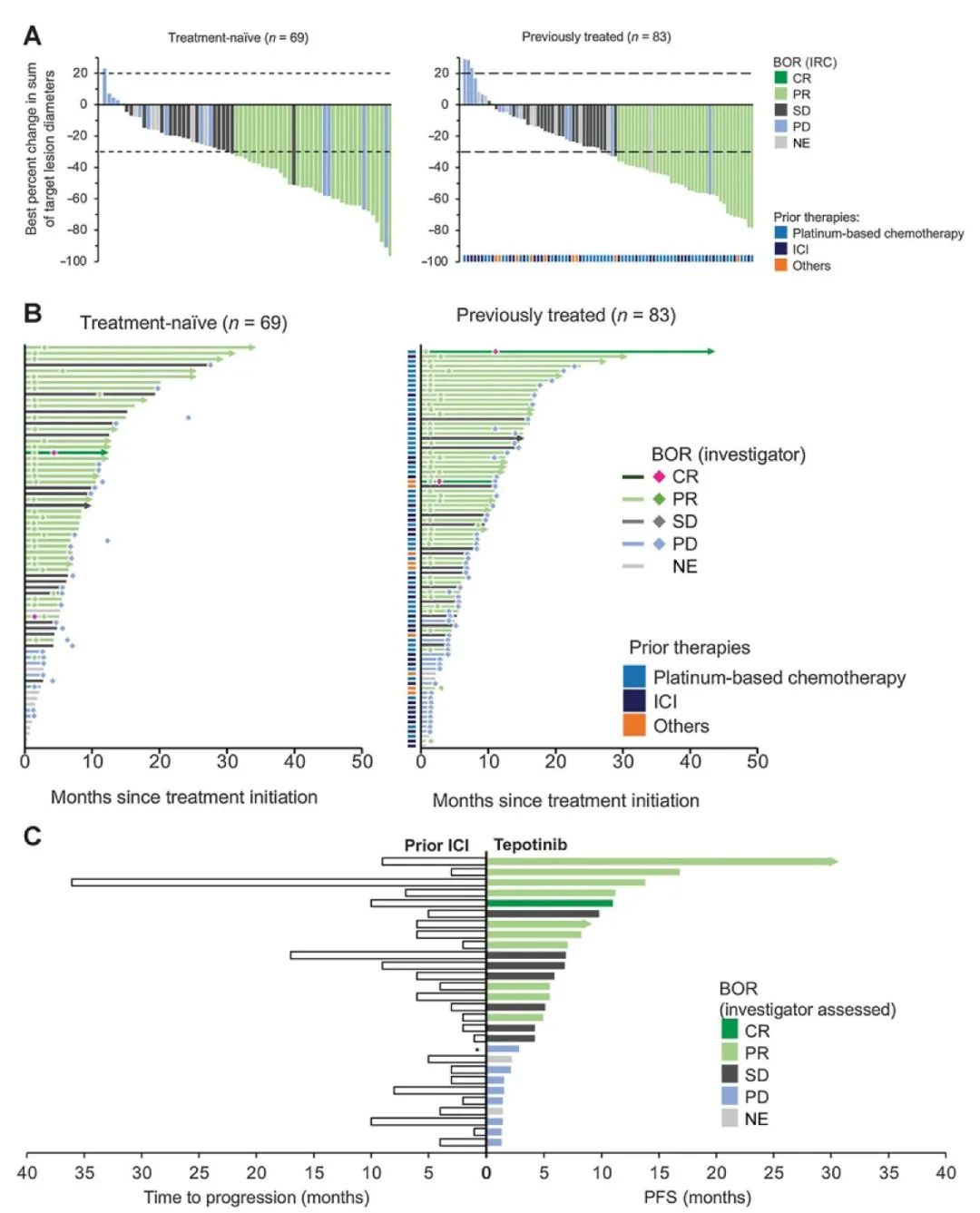
小细胞肺癌(SCLC)约占每年新发肺癌病例总数的15%-20%,占肺癌死亡人数的25%,恶性程度高,极易出现远处转移和获得性耐药,预后极差,5年生存率只有不到5%。局限期患者中位生存期在16-24月,而广泛期患者仅7-12月。目前,一线治疗都以放化疗为主。虽然小细胞肺癌化放疗缓解率较高,但其细胞恶性程度高,增长迅速,大部分患者因短期内出现进展而失败。尽管各种新药已经在SCLC的不同环境中进行了测试,但到目前为止,它们都没有获得监管机构的批准。因此,寻找新的,有效的治疗方式成为小细胞肺癌治疗的新目标。 肿瘤血管生成被认为是癌症的十大标志之一。血管生成对肿瘤进展至关重要,因为肿瘤细胞生长所需经常超过氧气和营养物质的供应。血管生成受开关调节,包括促血管生成因子如血管内皮生长因子A(VEGF-A)和抗血管生成因子如血小板反应蛋白-1(TSP-1)之间的平衡。这些生理调节剂的表达受到恶性肿瘤的直接或间接影响,从而使血管生成开关倾向于其活化。缺氧是肿瘤血管生成,转移和影响化学疗法或免疫疗法敏感性的重要因素,并且可能是预后不良的指标。在缺氧时,通过上调缺氧诱导因子(HIF1α和HIF-2α)来刺激血管的生成,并反过来诱导VEGF的产生,结合并激活了VEGFR,从而激活了VEGF途径,这是血管生成的病理生理学核心。台湾学者的一项研究,使用了43个石蜡包埋的活组织材料,进行了Kaplan-Meier分析,其中84%的SCLC患者出现HIF-1α表达。此外,与HIF-1α表达水平低的患者相比,表达水平较高的患者存活时间明显缩短,且更易发生远处转移。在HIF-1α的数百个靶点中,已广泛研究的靶点是VEGF,VEGF对诱导血管生成非常重要,它试图恢复不良的血管化肿瘤区的氧气和营养物质的产生。在多种肿瘤中均占据重要的治疗地位。例如非小细胞肺癌、肝癌等。并有研究证实小细胞肺癌中VEGF的过表达导致新生血管形成,与患者预后差相关。因此,研究者一直在探索抗血管生产治疗在小细胞肺癌中的作用。 目前为止,抗血管生成治疗的发展主要集中在VEGF及VEGF受体(VEGFR)抑制剂的开发上。阻断VEGF的单一疗法降低了微血管密度,抑制了许多类型癌症的皮下人异种移植物中的肿瘤生长。抗血管生成治疗甚至导致转移明显减少。如抗VEGF抗体贝伐单抗。配体与其受体(例如VEGF和VEGFR)的结合激活受体的酪氨酸激酶结构域的活性并上调下游信号系统。所以酪氨酸激酶抑制剂(TKI)和单克隆抗体被开发用于抑制VEGF受体及其下游靶标,以抑制内皮细胞增殖并破坏营养物和氧气的血管供应。如抗VEGFR2抗体Apatinib/ target=_blank class=infotextkey>阿帕替尼。 此外,免疫疗法一直在改变肿瘤治疗的模式。抗血管生成治疗和免疫疗法的结合是否能产生预期的疗效已经成为了一个热门话题。新的证据表明,抗血管生成疗法不仅可以抑制新血管形成,还可以调节免疫微环境。活化的T细胞分泌干扰素-γ(IFN-γ),其可以直接促进肿瘤血管正常化并通过IFN-γ受体在肿瘤内皮细胞上消退。基于肿瘤免疫和血管生成之间的相互作用,推测抗血管生成可以增强免疫检查点抑制剂(ICI)的功效。Meder等人通过基因工程对小细胞肺癌小鼠进行了临床前研究。将所有携带SCLC的小鼠随机分组。其中,抗血管联合PD-L1免疫治疗组与单一抗血管或单一免疫治疗相比生存疗效最佳。此外,与对抗PD-L1敏感的小鼠相比,抗PD-L1抗性小鼠的T细胞丰度显著增加。然而,通过抗VEGF加抗PD-L1治疗可以使逆转排出的T细胞比例的增加。为了证实VEGF对免疫检查点表达的影响,从SCLC患者的外周血中获得人T细胞。用VEGF刺激后,T细胞上PD-1和TIM-3的表达显著上调。基于临床前研究的令人鼓舞的结果,已经有许多关于小细胞肺癌免疫联合抗血管生成治疗的研究正在进行中。我们有理由相信免疫治疗联合抗血管生成将成为治疗癌症的新策略。 盐酸安罗替尼(Anlotinib)是一种多靶点酪氨酸酶抑制剂,并且是目前唯一已经批准的用于SCLC三线及以上患者的抗血管生成药物。ALTER1202试验是一项研究安罗替尼治疗三线及以上小细胞肺癌的II期随机双盲多中心临床试验,共招募了120名SCLC患者。患者以2:1的比例随机分配接受安罗替尼组或安慰剂组。主要终点是无进展生存期(PFS)。安罗替尼组和安慰剂组的中位PFS分别为4.3个月vs 0.7个月。中位总生存期(OS)分别为7.3个月vs 4.9个月。疾病控制率(DCR)也优于安慰剂组71.6%vs13.2%。在该研究中观察到的毒性特征类似于之前在NSCLC中的研究。3-4级毒性略高于安慰剂组,咯血是最严重的不良反应。安罗替尼将患者的OS显著延长了2.4个月,死亡风险降低了47%,表现出其疗效的优越性。这是近15年继依托泊苷联合铂类(EP方案)获批治疗小细胞肺癌后,首个在该领域获批的新药。 贝伐珠单抗(Bevacizumab,BV)是一种抗血管内皮生长因子单克隆抗体,意大利的一项III期临床研究对205例先前未接受全身治疗的ED-SCLC患者进行的EP联合贝伐单抗方案治疗,主要终点是OS。研究表明,联合用药组PFS对比化疗组为6.7个月vs 5.7个月,OS对比为9.8个月vs8.9个月。客观缓解率(ORR)和PFS有了明显改善。Heng Lin等进行的SCLC抗血管生成治疗的荟萃分析中对贝伐的作用进行了亚组分析,结果表明,虽然ORR和PFS的延长未能转化为OS的延长,但贝伐在改善ORR和PFS中仍起关键作用。 Apatinib/ target=_blank class=infotextkey>阿帕替尼(Apatinib)作为我国自主研发的抗血管生成药物,通过与VEGFR-2结合,来竞争性抑制VEGF与VEGFR-2结合及后来的VEGFR-2自动磷酸化,从而发挥强有力的抗肿瘤作用。洪卫等的一项评估阿帕替尼在二线及以上化疗失败后广泛期小细胞肺癌患者中的疗效和安全性研究。共观察13例患者,阿帕替尼中位PFS为2.8个月,DCR为81.8%。最常见的治疗相关不良事件是继发性高血压、口腔黏膜炎、手足皮肤反应和乏力。刘雨桃等评估了阿帕替尼用于既往接受过二线及以上化疗进展的SCLC患者的疗效。研究入组22例患者,可评估疗效患者19例。1例患者取得部分缓解(PR),15例患者病情稳定(SD),DCR率为84.11%,中位PFS为140天。高血压,蛋白尿等不良反应均可通过减少药物剂量得到缓解。范云等进行的一项单臂多中心II期研究,评估阿帕替尼在二/三线化疗后广泛期患者中的疗效和安全性。共入组40例患者。ORR为22.2%,DCR为77.8%。中位PFS和中位OS分别为86天和105天。综上,对于多线治疗失败的小细胞肺癌患者,阿帕替尼可以延长患者生存时间,相关不良反应多为可预测可耐受范围内。 帕唑帕尼(Pazopanib)是VEGFR-1/2/3,PDGFR-α/β和c-Kit受体的多激酶抑制剂。希腊学者进行的单臂多中心II期临床研究诊断铂敏感和耐药难治性SCLC的患者。在所有入选的58名患者中,8名患者PR,20名患者的SD和30名患者疾病进展(PD)。两组患者中,中位PFS分别为3.7个月和2个月,中位OS分别为8.0个月和4个月,1年生存率为26.5%和10.5%。毒性特征与先前在肾细胞癌中使用帕唑帕尼的研究中报道的相似,其中转氨酶升高是最普遍的3-4级不良反应。韩国进行的一项随机,安慰剂对照的II期临床研究,选取了97名EP方案四个周期后未发生进展的广泛期小细胞肺癌患者,1:1分配至安慰剂或帕唑帕尼组,直至进展或不可接受的毒性反应。主要终点是PFS。帕唑帕尼治疗组和安慰剂组的中位PFS分别为3.7个月vs 1.8个月,中位OS分别为10.6个月vs 12.9个月,该研究显示PFS显著改善,然而,PFS的好处并没有转化为提高整体生存率。但是,在帕唑帕尼维持治疗期间,9名患者的长期PFS超过6个月,而安慰剂组仅有2名患者。3名患者实现了额外的部分缓解,而安慰剂组没有部分或完全缓解。主要不良反应包括:血小板减少症(10.4%),肝酶升高(10.4%),疲劳(6.3%)和高血压(6.3%)。 04 / 结语 总体来看,在过去几十年小细胞肺癌治疗的研究中,抗血管生成治疗在临床中得到了一定的疗效,大多表现为PFS的增加。这符合肿瘤血管生成是癌症标志的概念。部分抗血管生成药物在临床实验中表现出很强的抗癌作用,所以深入研究肿瘤内血管发生机制,抑制特定靶点杀伤肿瘤细胞,将会成为未来研究的热点,这也预示着小细胞肺癌的治疗可能从传统化疗转换为一个新模式,同时,抗血管生成联合免疫治疗组合的出现带来的阳性结果也值得我们广泛关注,这可能成为小细胞肺癌治疗的潜在希望。
01 / 抗血管生成治疗的作用机制
02 / 抗血管生成治疗联合免疫治疗
03 /抗血管生成药物